【我的代表作】氧化锌纳米颗粒利用自噬诱导肺上皮细胞的细胞死亡
研 究 背 景
有请本文中的主角——纳米氧化锌 登场~~只是听名字,或许大家会觉得比较陌生,但其实它在我们生活中无处不在。人们利用其在光、电、磁、敏感等方面的奇妙性能,极大地拓展了了它的“势力范围”。比如橡胶陶瓷制造业中作为添加剂,改善产品性能;在电力电子方面是应用最广泛的压敏变阻器材料;在纺织工业中,因为其具有良好的防晒、抗菌、除臭等功能,所以被广泛添加;在动物饲料中,用纳米氧化锌饲料替代高锌饲料,既可以解决动物体对锌的需求量,又可改善动物的生殖能力;甚至在化妆品、颜料、涂料、临床器械等方面都可见到它的影子。
但是任何事物都有两面性,在纳米氧化锌广泛应用的同时,它对人体的毒性作用正逐渐引起人们的担忧。目前人们接触纳米氧化锌的主要途径是皮肤和呼吸道。据报道,吸入氧化锌会导致人体金属烟雾热。因此邹老师的团队主要研究纳米氧化锌对呼吸道的毒性及其机制。
那么纳米氧化锌是怎么对人体造成损害的呢?先前的研究认为,最常见的机制是纳米氧化锌引起的活性氧和炎症。另一个比较被认可的毒性相关机制是其释放的锌离子,在生物环境中可引起细胞器损伤。近年来,自噬被认为是纳米材料毒性的潜在机制。
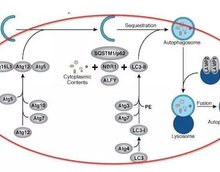
自噬的基本机制如下图所示:

一般认为自噬从细胞中形成小的吞噬泡开始,随后进入细胞,与细胞中的Atg5–Atg12蛋白结合并产生相互作用,随后LC3插入延伸的吞噬泡膜,以促进其对细胞内物质(包括异常细胞器、蛋白质、病毒和纳米材料)的吞噬。自噬泡可进一步与溶酶体融合形成自噬体,而溶酶体内的内含物降解后可被循环利用。溶酶体的完整性对自噬至关重要。溶酶体自身酸性环境和溶酶体内大量水解酶促进细胞内物质的降解。自噬泡的形成、自噬泡与溶酶体融合以及细胞内物质的降解这一连串动态的过程称为自噬流,反映了自噬降解的速率。在以上的过程中,如果溶酶体功能出现障碍,则可导致不完全自噬。
但是现在纳米氧化锌是否确实诱导自噬尚未得到证明。有研究表明,氧化锌在酸性环境中溶解更快,这说明氧化锌可能在溶酶体中被溶解,并在分化的THP-1细胞中引起溶酶体功能障碍。同时也有人发现经纳米氧化锌处理后,锌离子在肺泡上皮细胞的内含体和溶酶体中蓄积。然而,溶酶体功能紊乱的调节机制和生物学效应仍然不确定。因为在分子水平上,自噬可受多种因素影响,如LC3II/LC3I比值升高、自噬体积累、自噬诱导或自噬流的受损。因此,应进行综合分析来明确纳米氧化锌是否诱导自噬。此外,应谨慎评估阻断自噬流对机体的后续效应。因为当自噬流被阻断时,受损线粒体的清除也会受到影响,这可能是自噬与活性氧之间的联系。
基于之前的研究结果,邹老师团队采用肺泡上皮细胞进行体外实验,研究氧化锌纳米粒子利用自噬诱导肺上皮细胞死亡的毒作用机制。
探究一:
邹老师团队首先证明了纳米氧化锌可释放锌离子,而后者导致肺泡上皮细胞死亡。
本次实验选用的纳米氧化锌的粒径约为50nm,形态大致呈球形。呼吸道的上皮细胞被认为是阻止空气中外界化学物进入人体的第一道屏障,所以当其暴露于高浓度的纳米颗粒时,很容易受到伤害。而肺泡上皮细胞属于呼吸道上皮细胞,所以当肺泡上皮细胞损伤时就标志着急性肺损伤。为了确定氧化锌是否能诱导呼吸道上皮细胞死亡,邹老师团队采用10、30和100μg/ml纳米氧化锌处理肺泡上皮细胞模型A549细胞(以下简称A549细胞)。结果显示,剂量为30和100μg/ml的纳米氧化锌处理组可诱导显著的细胞死亡(图1a)。这提示氧化锌可能引起肺泡上皮细胞损伤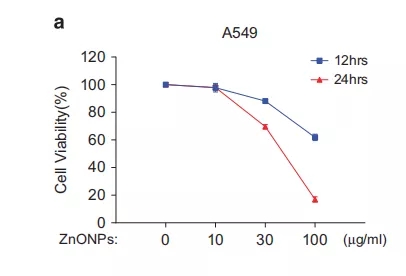
邹老师团队推测纳米氧化锌在细胞中溶解,并释放锌离子是纳米氧化锌产生细胞毒性的原因之一,所以采用锌离子的一种特殊指示剂来检测细胞内锌离子浓度。结果显示,纳米氧化锌处理的A549细胞锌离子信号显著升高。同时,锌转运蛋白1(ZnT1)的mRNA表达水平也升高。
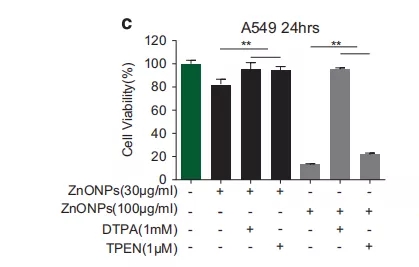
为了确定锌离子浓度的升高是否与细胞死亡有关,在氧化锌处理前1h加入锌离子螯合剂(可与锌离子结合)即二乙基三胺五乙酸(DTPA)和2-吡啶基甲基乙二胺(TPEN)。结果表明,在30和100μg/ml的剂量下,锌离子螯合剂的使用可减轻由锌离子诱导的A549细胞死亡(图1c);同时DTPA可以显著降低细胞内锌离子浓度,并通过实验排除了纳米氧化锌是通过影响纳米材料进入细胞从而缓解细胞死亡的可能性。总之,这些数据表明锌离子是纳米氧化锌诱导肺泡上皮细胞死亡的关键分子。
探究二:
邹老师团队还证明了纳米氧化锌可诱导细胞自噬。
使用纳米氧化锌处理A549细胞后,透射电镜观察结果显示,细胞质膜包裹纳米氧化锌,并在6小时后形成吞噬泡样结构(图2a)。处理24小时后,A549细胞的自噬小体和自噬溶酶体显著增加(图2b)。

图2 为经纳米氧化锌处理后细胞的透射电镜图像 (a)红色箭头表示纳米氧化锌被包裹在细胞中 (b)红色箭头表示氧化锌诱导的自噬小体
同时,western blot分析结果显示,纳米氧化锌处理细胞6h后,自噬标记物LC3B-II/LC3B-I比率增加,并且在纳米氧化锌处理期间持续增加(图2d)。有趣的是,邹博士团队还发现,在纳米氧化锌处理的细胞中p62(自噬降解后的一种特异性底物)含量增加,并且表现出与LC3B-II/LC3B-I表达相同的趋势。这些结果表明,纳米氧化锌可能能诱导A549细胞发生自噬。

图2d 经0、3、10和30μg/ml氧化锌处理的A549细胞在24h后LC3和p62表达水平
此外,经纳米氧化锌处理的A549细胞中的黄点显著增加(图2e和f),可以证实纳米氧化锌阻断了自噬流表达。
【扩展阅读】在稳定表达mRFP-GFP串联荧光标记的LC3(tfLC3)的转基因细胞中,由于GFP荧光在溶酶体的酸性环境中不稳定,因此在与溶酶体融合前,tfLC3中标记的mRFP-GFP信号融合为黄色点状,随后在自噬溶酶体内仅显示出mRFP信号。因此,自噬体和自噬溶酶体分别用黄色(即mRFP和GFP)和红色(即仅mRFP)信号标记。经过自噬诱导剂雷帕霉素(rapamycin)处理的细胞比未经处理的细胞诱导更多的红点,表明自噬流增强。通过bafilomycin A1与rapamycin共处理,观察到许多黄色斑点,表明自噬流被阻断。
然而,黄点增加仅足以表明自噬底物的增加与自噬体的积累,无法明确黄点的增加到底是自噬流受损的结果,还是是由自噬诱导引发。
为了再次确认纳米氧化锌处理后是否诱导自噬,在氧化锌处理前1h用bafilomycin A1对A549细胞进行预处理。Western blot结果表明,用纳米氧化锌和bafilomycin A1共处理的细胞中,LC3b-II和p62的水平升高。这表明纳米氧化锌可诱导自噬。
综合以上结果,纳米氧化锌不仅诱导自噬,而且损害肺泡上皮细胞的自噬流表达。
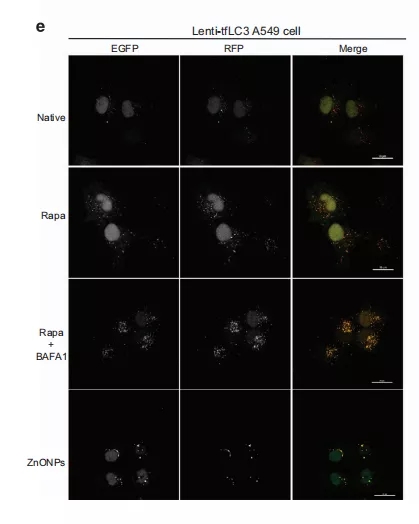
图2e 用RAPA(2μM)、RAPA+BAFA1(100 nM)处理4 h或用30μg/ml 纳米氧化锌处理24 h,稳定表达A549细胞的TFLC3,福尔马林固定后获得共聚焦图像。
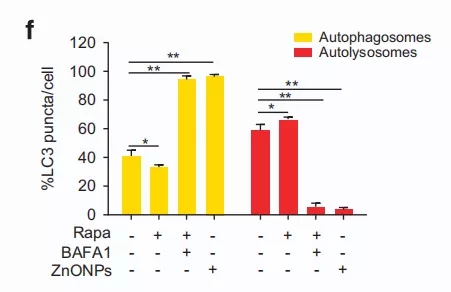
图2f 黄色点状(自噬体)和红色点状(自噬溶酶体)的数目,并以百分比计算
探究三
:邹老师的团队还进一步探究了,纳米氧化锌的细胞毒性是否是由于细胞自噬导致的。
为了阐明自噬诱导与纳米氧化锌介导的细胞毒性之间的关系,将A549细胞分为两组,一组经3-MA自噬抑制剂预处理后再用纳米氧化锌处理,另一组仅使用纳米氧化锌处理,结果发现经自噬抑制剂预处理组的细胞活力显著提高,同时,自噬导剂还抑制了纳米氧化锌诱导的LC3B-II/LC3B-I比值和p62表达的升高(图3b),并降低了纳米氧化锌处理后细胞内锌离子浓度。并且将在自噬过程中起着中心作用的beclin 1基因敲除后,可以改善纳米氧化锌处理后的细胞活力。此外,使用DTPA(上述锌离子螯合剂)可显著降低纳米氧化锌处理细胞后LC3b-II/LC3b-I比率和p62表达,这表明锌离子的释放肯定与自噬有关。
总之,上述数据表明自噬诱导与锌离子浓度的升高和锌离子诱导的细胞死亡呈正相关。
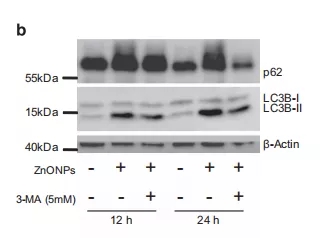
图3 (b)不同处理组LC3b-II、LC3B-I和p62表达情况,β-肌动蛋白作为负荷控制
探究四
:既然已经证明纳米氧化锌中锌离子释放与诱导细胞自噬有关,那么这个过程是通过什么信号通路进行的呢?
此前研究表明,自噬的重要调控机制有两种,一种是抑制mTOR信号的激活,另一种是AMP依赖的蛋白激酶(AMPK)的激活。邹老师团队发现:在纳米氧化锌处理后,p-mTOR水平没有显著改变,而p-AMPKα(磷酸化的AMPK,提示该信号通路激活的)表达水平明显上调(图4a);同时发现,作为mTOR上游调节因子的蛋白激酶B/Akt的磷酸化水平在纳米氧化锌处理后显著升高。正常情况下,在丝氨酸9处,p-AKT可以快速磷酸化糖原合酶激酶3β(GSK3β),在纳米氧化锌处理后,p-GSK3β(Ser9)表达水平上调,进一步证明纳米氧化锌可诱导p-AKT的升高。他们推测,可能是p-AKT的快速增加阻断了p-mTOR的下调。
此外,邹老师团队观察到相比于纳米氧化锌处理组和siRNA处理的对照组而言,AMPKα敲除后引起了细胞活力的升高(图4d),这表明AMPKα的激活可能与纳米氧化锌诱导的细胞死亡有关。
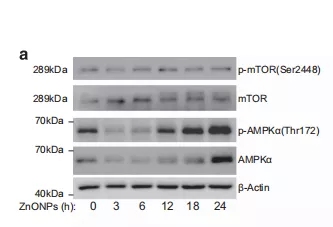
图4a 经纳米氧化锌处理的A549细胞mTOR, p-mTOR, AMPKα, p-AMPKα的表达水

图4d MTS分析检测不同处理组A549细胞的活力
探究五
:既然找到了信号通路,那么纳米氧化锌是怎样引起细胞自噬的呢?
纳米氧化锌传递到溶酶体并在溶酶体中溶解可导致溶酶体功能障碍和自噬流受损。为了确定纳米氧化锌处理细胞后如何引起自噬流的阻断,采用LysoTracker DND-99标记溶酶体,结果发现经纳米氧化锌处理的细胞中溶酶体LysoTracker DND-99的荧光信号增强,表明酸性溶酶体数量增加。同时,纳米氧化锌处理的细胞中LAMP-1/2表达也发生异常(图5b)。此外,邹博士团队还观察到DTPA(上述锌离子螯合剂)可以改善异常LAMP-1/2的表达,减少纳米氧化锌处理后细胞中的溶酶体数量(图5d)。
这表明纳米氧化锌被溶酶体溶解后产生的锌离子诱导了溶酶体活化和异常LAMP-1/2表达。
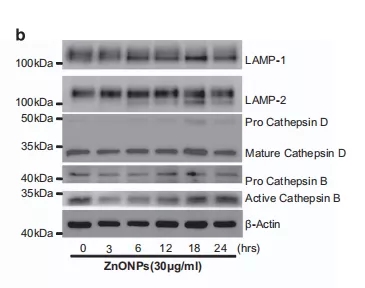
图5b 纳米氧化锌(30μg/ml)处理的A549细胞中,LAMP-1、LAMP-2、组织蛋白酶B和组织蛋白酶D的表达水平进行Western blot分析。
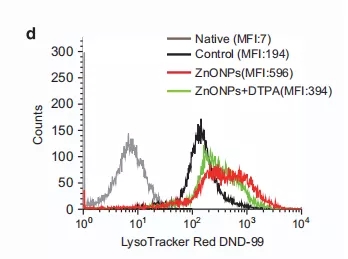
图5d DTPA预处理A549细胞,然后用纳米氧化锌(30μg/ml)处理。检测处理后24小时溶酶体的数量。
为了证实LAMP(溶酶体相关膜蛋白)是否参与了纳米氧化锌诱导的细胞死亡,在用纳米氧化锌处理前对LAMP-1/2进行了敲除。结果发现,LAMP-1和LAMP-2表达降低,并且对A549细胞的自噬水平和生存能力没有显著影响。然而,有趣的是,LAMP-2的敲除增加了纳米氧化锌诱导细胞死亡的可能性(图5e)。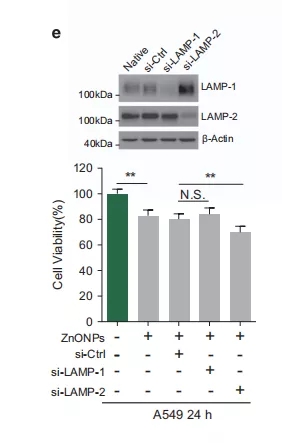
图5e 对不同处理组蛋白表达及细胞活性的测定
已有研究表明,LAMP-2参与了自噬体与溶酶体的融合,可能有助于线粒体自噬的完成。而正常的线粒体自噬可以有效清除受损线粒体,从而减少过量的活性氧。邹博士团队进一步思考,既然已有的研究表明纳米氧化锌可引起LAMP-2表达异常,那么纳米氧化锌的毒性是否与线粒体损伤及过多活性氧(ROS)有关?
为了验证以上假设,邹博士团队采用DCHFDA活性氧分子探针标记纳米氧化锌处理的细胞,以检测细胞内的活性氧水平。结果发现纳米氧化锌导致细胞内ROS水平显著升高;而用抗氧化剂和自由基清除剂预处理后,不仅可以减轻纳米氧化锌诱导细胞死亡(图6a),还可清除氧化锌处理后过量的活性氧(图6b)。此外,自由基清除剂可降低纳米氧化锌处理后的LC3B-II/I比值,p62和异常的LAMP-1/2表达,提示了ROS与自噬之间的相互作用。这些数据表明,纳米氧化锌处理可以诱导活性氧的产生,并诱导细胞死亡。
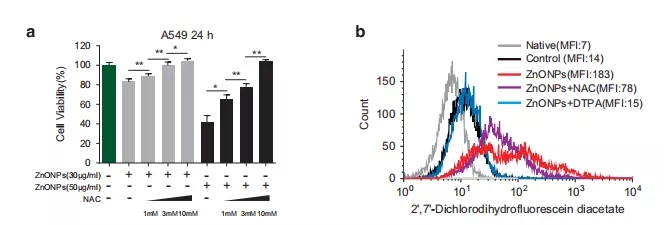
图6 (a) 用1、3或10 mM的自由基清除剂对A549细胞进行预处理,然后用30或50μg/ml的纳米氧化锌处理,检测处理后24小时的细胞活力。(b)用自由基清除剂(10 mM)或DTPA(1 mM)对A549细胞进行预处理,然后用30μg/ml的纳米氧化锌处理24小时后,用2'7’-二氯荧光素二乙酸酯对细胞进行处理后分析
为了确定纳米氧化锌处理是否诱导线粒体损伤,邹老师团队用四甲基磷酸钠高氯酸乙酯(TMRE)对A549细胞进行染色。结果表明,纳米氧化锌处理降低了TMRE荧光信号,说明线粒体受到损伤。另一方面,透射电镜图像显示,与未处理的细胞相比,经纳米氧化锌处理的细胞中异常线粒体的积累(图6c)。此外,采用线粒体绿色荧光染料对细胞内线粒体进行标记后,纳米氧化锌处理的细胞中探测到的荧光信号增加,表明A549细胞中线粒体积累(图6d)。
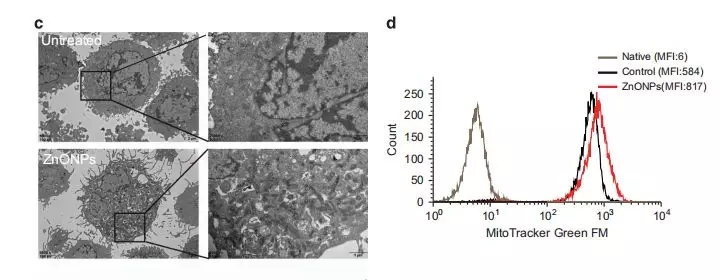
6 (c) 不同处理组A549细胞的透射电镜图像 (d)不同处理组对线粒体质量的影响
那么LAMPs是否通过影响有丝分裂和活性氧的调节而导致受损线粒体的累积呢?邹老师团队进行了SiRNA介导的LAMPs敲除实验。结果发现LAMP-2的敲除显著增加了线粒体损伤细胞的比例(图6e),并诱发了过多的ROS生成(图6f)。然而,LAMP-1基因敲除似乎与线粒体损伤积累和过多的ROS生成无关。
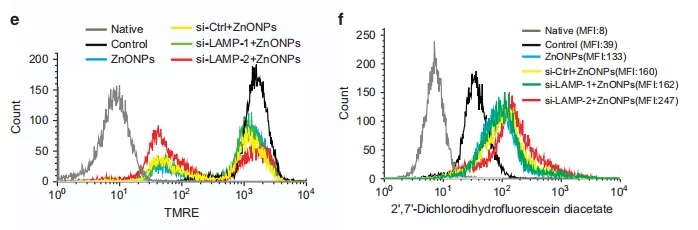
图6 (e) 不同处理组的线粒体膜电位 (f)不同处理组ROS水平
研 究 总 结
上述研究结果证明,纳米氧化锌溶解产生的锌离子可破坏线粒体和溶酶体,进一步破坏ROS(活性氧)与线粒体自噬间的负反馈机制,导致受损线粒体堆积、ROS(活性氧)产生过量和细胞死亡。
综上所述,邹老师团队证明,纳米氧化锌诱导的细胞死亡是由于线粒体损伤累积和活性氧产生过多,进而导致自噬流损伤的级联反应所致。而以上过程中起关键作用的可能是溶酶体中锌离子释放引起的异常LAMP-2表达。
科学不会随着一项研究的结束而止步,后续还有很多问题值得思考:锌离子超量会导致细胞毒性,而锌离子缺失亦会产生细胞毒性,那么细胞是如何在锌离子超量/缺失状态下进行锌离子稳态的调节?锌离子稳态的调节在急性肺损伤中的作用是什么?值得我们进一步探索。
 1
1
 2
2
 3
3
 4
4
 5
5
 6
6